《掘金创新药》由国家商报联合药物数据联合推出,旨在解读新药研发进展和趋势,分析产品竞争力和市场前景,洞察医药资本脉络,见证医药行业高质量发展。
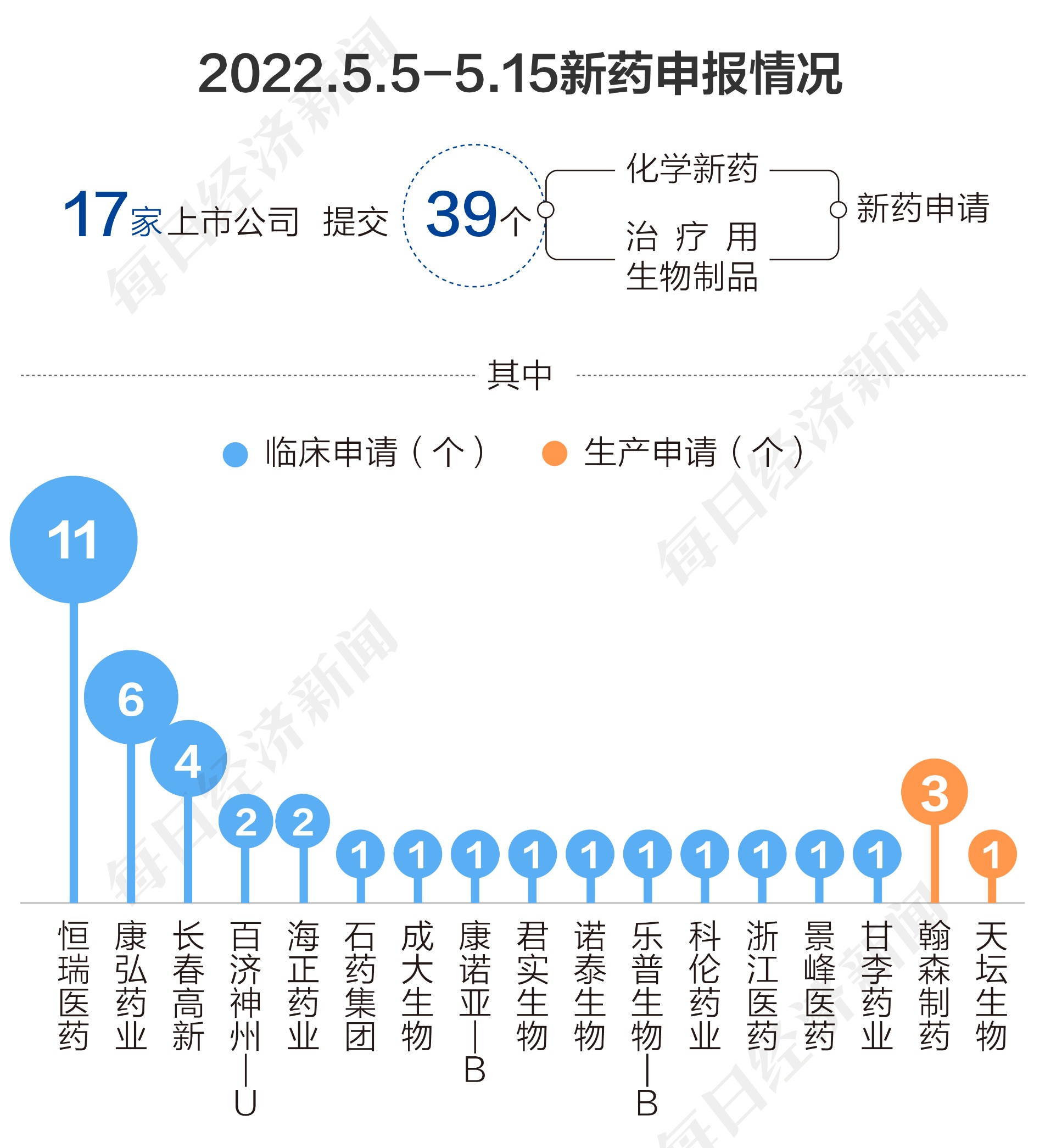
新药申请
2022年5月5日至5月15日,针对上市公司,恒瑞药业提出11项临床申请,康弘药业提交了6项临床申请,长春高辛提出4项临床申请,百济神舟—U,海正药业甘药业,景峰药业,浙江制药,科伦药业,乐普生物B和诺泰生物汉森制药申请了3个生产申请,天坛生物申请了一个生产应用
新药热评
1.恒瑞医药PD—1国际三期临床数据已经出炉,进入出海倒计时。
日前,恒瑞医药在公告中披露了其自主研发的PD—1单克隆抗体联合甲磺酸阿帕替尼片国际多中心ⅲ期临床试验的最新结果根据独立数据监测委员会的数据,本次临床试验的主要终点结果达到了预设的优良有效标准
共有543名受试者参加了本次临床试验将他们按照1:1的比例随机分组,分别用卡列珠单抗联合阿帕替尼或索拉非尼治疗
值得注意的是,本次卡瑞珠单抗ⅲ期临床研究是恒瑞医药开展的首个国际多中心ⅲ期临床研究,由南京金陵医院肿瘤中心秦叔逵担任全球首席研究员,全球13个国家和地区的95个中心共同参与。
结果显示,与索拉非尼相比,卡列珠单抗联合阿帕替尼作为一线治疗,可显著延长晚期肝癌患者的无进展生存期和总生存期。
目前,karelizumab联合阿帕替尼用于一线治疗过去未接受系统治疗的不可切除或转移性肝癌患者的上市许可申请已被中国国家医疗产品管理局受理恒瑞医药表示,计划近期向FDA提交新药上市的沟通申请
行业洞察:
根据恒瑞医药的公告,目前已获批肺癌,肝癌,食管癌,鼻咽癌,淋巴瘤五种肿瘤类型中的8个适应症,与百济神州的tirelizumab并列为国内获批适应症最多的PD—1单克隆抗体。
除了这两个,目前国内批准上市的抗PD—1单克隆抗体还有5个,分别是君实生物的Trepril单克隆抗体,信达生物,郑达天晴和康方生物的Ampley单克隆抗体,宇恒生物的Sepali单克隆抗体,傅宏翰林的Silulimab。
国外批准上市的PD—1单克隆抗体有四种,分别是默沙东的Pabolizumab,百时美施贵宝的Nivolumab,Regeneron Pharmaceutical的cemiplimab和葛兰素史克的dostarlimabPabolizumab和Nivolumab都已获准在中国上市
目前业内一致的观点是,在国内市场竞争激烈的背景下,所有PD—1出海是大势所趋信达生物,君实生物,百济神州,康方生物均已向FDA提交新药上市申请从出海进度来看,恒瑞医药的Karelizumab已经落后于竞争对手
不过总体来说,国产PD—1的出海之路并不顺利今年2月,信达生物的sindilizumab未能实现差异化,被FDA要求补充额外的临床试验,以证明其产品在美国人群中的适用性,5月4日,君实生物宣布FDA要求进行质量控制流程变更君生物计划直接与FDA见面,预计在2022年仲夏前重新提交曲普利麻生物制品许可申请
公司评论:
从恒瑞医药的年报来看,公司降本增效,持续投资R&D,加速出海的意图明显数据显示,公司2021年累计R&D投资为62.03亿元其中,境外R&D投资总额为12.36亿元,占R&D投资总额的19.93%
据《民族证券研报》统计,恒瑞医药在中国,美国,欧洲,澳洲,日本建立了R&D中心,R&D团队超过5400人,其中海外R&D团队超过170人目前公司已开展国际临床试验近20项,其中国际多中心三期项目7项,另有10余项研究处于准备阶段
掘金创新医药研究员认为,虽然国内PD—1的FDA申请接连受挫,但对于出海进度略显落后的恒瑞医药来说,未必是坏事如果Karelizumab能够贯彻差异化创新的原则,或许有可能在出海途中弯道超车同时,伴随着国际化的推进,海外市场销售收入有望成为恒瑞医药新的增长点
2.上海疫情下,首个公布奥米克隆临床研究结果的公司君实生物VV116有何影响。
数据显示,首次核酸阳性检测5天内使用VV116的Omicron感染患者核酸转阴时间为8.56天,短于对照组在有症状的患者中,在本研究的用药时间范围内给予VV116可以缩短患者的核酸转阴时间在药物安全性方面,使用VV116的患者未观察到严重的不良反应
但文章也指出,作为一项开放性,前瞻性的队列研究,本研究纳入的样本量有限,且所有受试者均未发展为重症或危重症因此,本研究未能收集到足够的数据来进一步分析VV116对重度Omicron感染是否有预防作用,仅初步评估了轻度患者核酸转阴的单一指标
5月初在乌兹别克斯坦举行的发布会上,首次披露了VV116的价格VV116在乌兹别克斯坦的价格为每次治疗185美元,折合人民币约1234元
行业洞察:
目前国内新冠肺炎的治疗只批准了腾胜博药—B的中和抗体疗法就R&D进展而言,截至目前,进入三期临床研究阶段的国产新冠肺炎口服药物只有三个,分别是真生物的阿夫定,君实生物的VV116和药物开发的普罗库胺,此外,格力药业,先声药业,云顶新药等药企也有布局,但都处于获批的临床或临床前阶段
目前,在世界范围内,已有多种新冠肺炎治疗药物在美国和欧洲市场获得批准,包括小分子口服药物,中和抗体和其他不同类型的治疗药物,其中包括辉瑞的帕昔洛韦,默沙东的莫那匹韦等取得了确切的疗效,并在世界范围内广泛使用
根据国泰君安发布的研究报告,小分子药物加中和抗体构建新冠肺炎的治疗体系,而海外大量使用中和抗体,因此小分子口服药物将成为轻中度疾病患者治疗的主力。
近期,R&D在新冠肺炎特定药物领域的进展和合作动向引起了资本市场的关注国产新冠肺炎口服药物已经正式获批,市场上的投资者已经开始下注,从药物R&D企业到上游原料供应商
4月下旬,新华制药宣布与真生物签署战略合作协议Bio—real同意新华制药在中国和双方同意的其他国家作为azvudine及其拥有的其他产品的制造商和经销商随后,新华制药股价连续11个交易日涨停日前,华润双鹤也发布公告称,与Real Bio签署了《战略合作协议》和《Azf定影液委托加工制作框架协议》双黄鹤将充分利用设备优势和生产条件,为新华制药提供良好的产品生产环境,促进真正的生物技术成果转化
5月19日晚间,海正药业发布公告称,公司与上海王石生物医药科技有限公司签署了《战略合作协议》和《委托生产框架协议》,双方拟在产品加工,生产,国际注册,市场开发等领域建立战略合作关系小分子创新药物VV116,有效期5年。
公司评论:
在市场上,有很多传言说Azvudine,一种真正的有机体,将成为第一个在新冠肺炎生产的批准的口服药物君实生物的VV116抛出了多项R&D和商业化进展,新冠肺炎制造的第一个国产口服药物最终会哪家去哪家,增加了许多变数
对于君实生物的投资者来说,一个普遍关心的问题是VV116的研发进度和特雷普利单克隆抗体的生产是否会受到上海疫情的干扰对此,国商报记者从君实生物了解到,公司位于香港附近的生产基地在疫情防控政策启动前,安排部分员工留在现场进行闭环管理,动态调整生产节奏,保持设备运转,保持不间断同时,君实生物还积极协调公司在沪以外的R&D和生产资源,保证在研项目的正常进行,保证商品化和临床用药的持续供应
最近几天,长城汽车旗下欧拉首款女性专属车型——芭蕾猫开始线上预售新车提供四个版本,包括401km和500km续航能力预售价从19.3万元到2
猴痘到底是什么目前有治疗方法或疫苗吗它会成为另一个疫情吗英国杂志《新科学家》网站5月19日报道,给出了这些与猴痘相关问题的答案 1.什么是
时隔一年,格力电器再推员工持股计划。 97%是针对中基层员工的。 公告显示,本次员工持股计划的持有人包括公司董事,监事,高级管理人员,以
规模以上工业增加值同比增长5.7%。 工业投资增长强劲,制造业投资同比增长37.1%。 刚需消费快速增长在18种主要商品中,11类商品零
特斯拉CEO马斯克昨天在推特上发文称,特斯拉正在成立一个核心诉讼部门,直接发起和执行诉讼团队将直接向自己汇报 马斯克还补充道,我们承诺:我
依然处于寒冬的房地产领域,暖风阵阵。 继5月15日央行,银监会宣布首套房贷利率下限下调20个基点后,5月20日,5年期LPR年内再次下调,
318国道康定市过境段通车。 318国道康定市过境段公路过大山隧道。四川日报全媒体记者蓝震摄 日前,318国道康定市过境段正式通车。
在一个漂亮的鸟头金钗上,两只鸟的喙很短,张开的翅膀下,环绕着羽毛最独特的是,鸟的头和脖子弯曲成心形 这件陈列在苏州博物馆西馆的碧馨金钗,长
预付款作为一种消费形式,已经在市场上广泛使用,涵盖了多种行业可是,长期以来,围绕预付款的问题很多,如消费者退款难,举证难,追偿难等,尤其是一
日本政府打算将药物流产合法化,但要求女性在购买流产药物前需要得到配偶的同意。 根据日本现行法律,只有手术流产才是合法的,原则上需要征得配偶
先驱网--综合性的生活资讯平台
邮箱:hchchc0324@163.com